Investigadores del IFLYSIB mostraron cómo los ácidos grasos entran y salen de una proteína sin abrir ni cerrar la puerta
Mediante rayos X y simulaciones computacionales refutaron una clásica hipótesis sobre el intercambio de lípidos en una molécula involucrada en el metabolismo intracelular.

Las proteínas transportadoras de ácidos grasos (FABP, por sus siglas en inglés) son una familia cuya estructura y forma semejante a un “barril” se conocen desde hace 25 años. Ahora bien, uno de los misterios que hasta el momento las rodea es la manera en que esos componentes entran y salen de la cavidad, y para explicarlo se han planteado varias hipótesis. Una de las más aceptadas postula la existencia de un portal a modo de “tapa” que se abre y se cierra para permitir el intercambio. Con experiencia en el estudio de este tipo de mecanismos, un equipo de científicos del Instituto de Física de Líquidos y Sistemas Biológicos (IFLYSIB, CONICET-UNLP) se propuso poner a prueba esta premisa a través de una investigación científica. Publicados recientemente en la revista PROTEINS: Structure, Function, and Bioinformatics, los resultados mostraron que los lípidos logran ingresar aun con el portal bloqueado, y lo hacen provocando modificaciones casi imperceptibles en la estructura.
Para abordar la investigación, los expertos produjeron un cristal de esta proteína, en el que la “tapa” del “barril” quedó prácticamente inmovilizada. Lo siguiente fue utilizar un lípido –o ácido graso– con bromo (Br), un elemento químico pesado que permite visualizarlo mediante difracción de rayos X, y sumergir el cristal en una solución con alto contenido del ácido graso marcado con Br. Una vez sometido a dicha técnica, los especialistas observaron claramente que el intercambio se había producido de todos modos, a pesar del confinamiento cristalino. “Contrario a lo que se viene sosteniendo, vimos que no hay un único camino de entrada; si le bloqueamos una ‘puerta’, el lípido busca otra. En este caso, comprobamos que simplemente con la oscilaciones de la molécula debidas a la temperatura alcanza para formar un orificio mínimo por el cual colarse”, señalan Eduardo Howard y Manuel Carlevaro, investigadores del CONICET en el IFLYSIB y autores del trabajo.
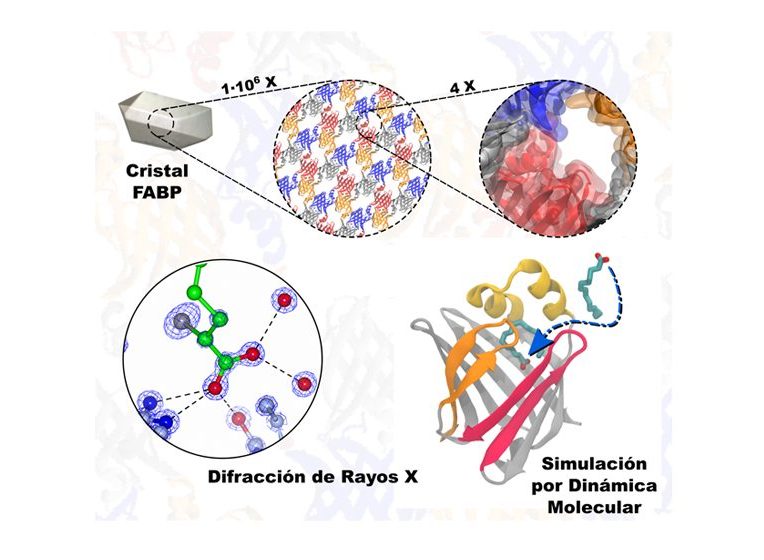
“Los ácidos grasos son moléculas importantes para el metabolismo. Tienen forma de gusano con un extremo o ‘cabeza’ soluble en agua, mientras que el resto de la cadena no lo es. Por eso necesitan de una proteína que los transporte en el interior de las células, que es acuoso, y aquí es donde intervienen las FABPs”, explica Ariel Alvarez, investigador de la Universidad Nacional de La Plata (UNLP) en el IFLYSIB y quien llevó a cabo el análisis de las simulaciones computacionales mediante una técnica llamada dinámica molecular, realizadas para complementar las pruebas experimentales con rayos X. “Lo que vimos es que la ‘cola’ del lípido se une a una región cercana al portal y de esa manera habilita un camino para que la ‘cabeza’ pase al interior. Lo que queda claro es que ese pasaje no implica un mecanismo de apertura y cierre del portal; la entrada es rápida y sucede sin grandes cambios estructurales”, añade Yanis Ricardo Espinosa, becario del CONICET en el IFLYSIB al momento de realizar este estudio .
Las proteínas transportadoras de ácidos grasos son muchas y están presentes en distintos tejidos y órganos. La estructura de barril es común a todas y, por lo mismo, se espera que el comportamiento también sea similar. Las fallas en el funcionamiento de ese transporte están relacionadas con ciertas complicaciones o afecciones de salud como obesidad, inflamación crónica, fallas cardíacas o cáncer. “Las conclusiones significan un aporte concreto al conocimiento sobre este mecanismo de intercambio de ácidos grasos entre el interior y el exterior de la proteína que los transporta dentro de las células. Saber más al respecto allana el camino para la búsqueda de tratamientos a las enfermedades asociadas, y podría servir, por ejemplo, para descartar estrategias terapéuticas que intenten bloquear distintas zonas de la proteína, ahora que sabemos que eso no funciona”, apuntan los científicos.
Referencia bibliográfica: Lipid exchange in crystal-confined fatty acid binding proteins: X-ray evidence and molecular dynamics explanation. H. Ariel Alvarez, Alexandra Cousido-Siah, Yanis R. Espinosa, Alberto Podjarny, C. Manuel Carlevaro, Eduardo Howard. PROTEINS: Structure, Function, and Bioinformatics. DOI https://doi.org/10.1002/prot.26546

